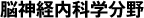医療と医学
2022.04.08
前頭側頭型認知症(FTLD-TDP)の凝集体は,驚くべきことにTDP-43ではなくTMEM106Bで構成されている!
神経変性疾患では,脳内にフィブリルと呼ばれる不溶性タンパク質の凝集体が形成されます.具体的にはアルツハイマー病やパーキンソン病,ALSなどでタウ,アミロイドβ,αシヌクレイン,TDP-43といったタンパク質がその供給源となります.従来の研究は,剖検脳から凝集体を発見し,構成する異常タンパクを生化学的に解析し,そのタンパク質に関連した遺伝子変異を見出し,変異タンパクの機能研究,最後にタンパク質線維の構造生物学を行うといった過程を経ました.しかし最新のNature誌,Cell誌に報告された3論文は従来とまったく異なり,ゴールであったクライオ電子顕微鏡を用いた凝集体の構造解析を出発点として,これまで注目されてなかったタンパク質にたどり着いています.
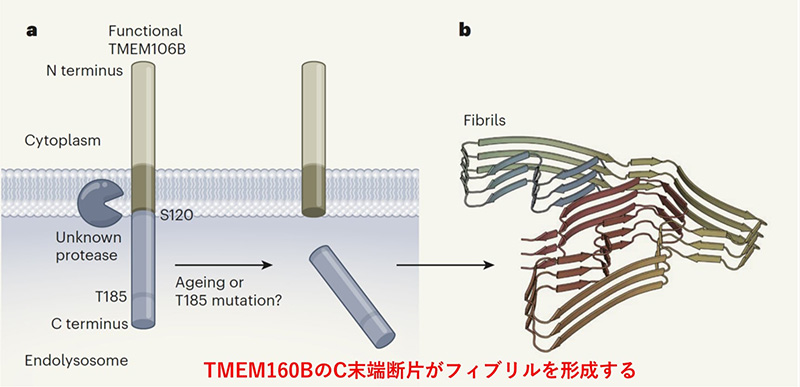
TDP-43の構造を解明しようとした3チームは,前頭側頭型認知症(FTLD)患者脳からTDP-43とは異なるフィブリルを発見しました.それはβストランドが豊富で,17~19本のセグメントから構成されていました.その正体は,3つの研究ともTMEM106B(Transmembrane protein 106B)というタンパク質のC末端であり,具体的にはエンドリソソーム内にあるはずのアミノ酸残基120-254番に一致していました(図).このC末端断片(29kDa)は長さと曲率が異なる複数のβシートからなるフィブリルを形成し,互いに積み重なり,プロトフィラメントを形成します.また119番と120番の間の切断がフィブリル形成に必須と考えられました.これまでTMEM106BはこのC末端以外を認識する抗体を用いて研究されており,このフィブリルが報告されてこなかったものと考えられます.実はこのTMEM106Bをコードする遺伝子は,FTLD-TDPのリスク因子と報告されたことがあります.注目すべきその機能は,エンドリソソーム経路に関与する膜貫通タンパク質で,液胞型ATPaseと相互作用してその活性を調節し,エンドリソソームのpHを変化することができます.
ただし3論文は同じTMEM106Bにたどり着いたものの内容は異なります.Schweighauserらは,神経変性疾患の有無にかかわらず,これらのフィブリルが加齢により認められるとしています.Changらが複数の疾患(FTLD-TDP,PSP,DLB)で同じフィブリルを観察しています.一方,JiangらはFTLD患者ではこのフィブリルを観察したものの,年齢をマッチした健常対照では認めませんでした.今後,多数例での検討が必要です.
TMEM106Bフィブリルの意義はまだ不明です.それ自体が疾患を引き起こす可能性のほか,リポフスチンのように加齢による脳の生理変化を見ている可能性もあります.加齢とともに蓄積し,神経変性を増強している可能性もあります.今後,疾患ごとのフィブリルの頻度やエンドリソソームへの影響などが明らかになるものと思われます.またこれらの研究で観察されなかったTDP-43については,その凝集体の大部分が,最近報告された規則正しい構造をとらないことを意味している可能性があります.まだ分からないことばかりですが,TMEM106Bという新たなキープレイヤーが出現し,神経変性疾患研究が大きく動く予感がします.
Nature NEWS(doi.org/10.1038/d41586-022-00873-2)
Nature (2022). https://doi.org/10.1038/s41586-022-04650-z
Nature (2022). https://doi.org/10.1038/s41586-022-04670-9
Cell https://doi.org/10.1016/j.cell.2022.02.026 (2022)