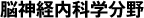多系統萎縮症の睡眠呼吸障害の治療(医師向け)
1. 睡眠障害の特徴
多系統萎縮症(multiple system atrophy;MSA)はさまざまな睡眠障害を呈します。睡眠時間の短縮や断片化(中途覚醒)のほか、REM睡眠行動障害、レストレスレッグス症候群を合併します。REM睡眠行動障害は、おもに運動症状の出現後に認めるパーキンソン病とは異なり、運動症状の出現前や出現早期に認められますが、REM期自体が病期の進行に伴い減少するため、徐々に目立たなくなります。一方、レストレスレッグス症候群の合併はパーキンソン病では有名ですが、MSAではむしろパーキンソン病よりも合併頻度が高いことが報告されています。
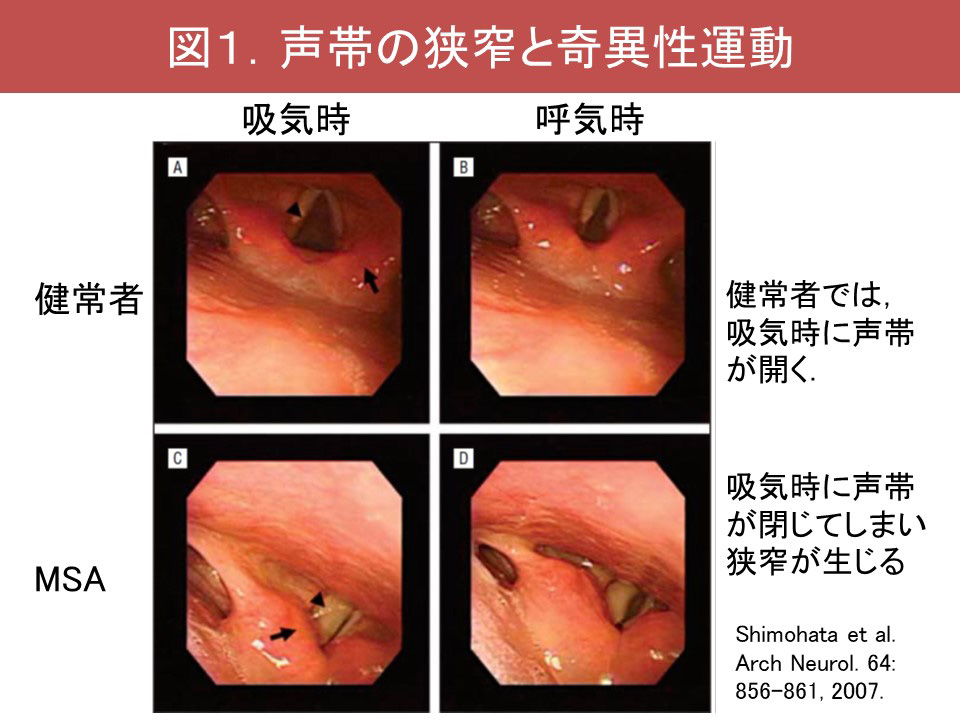
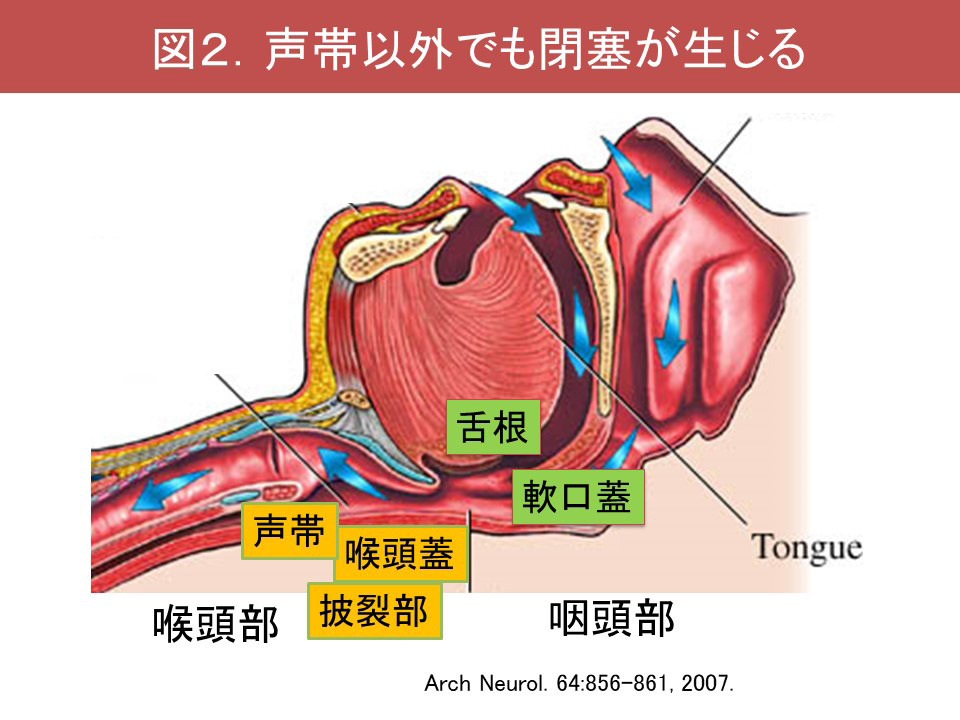
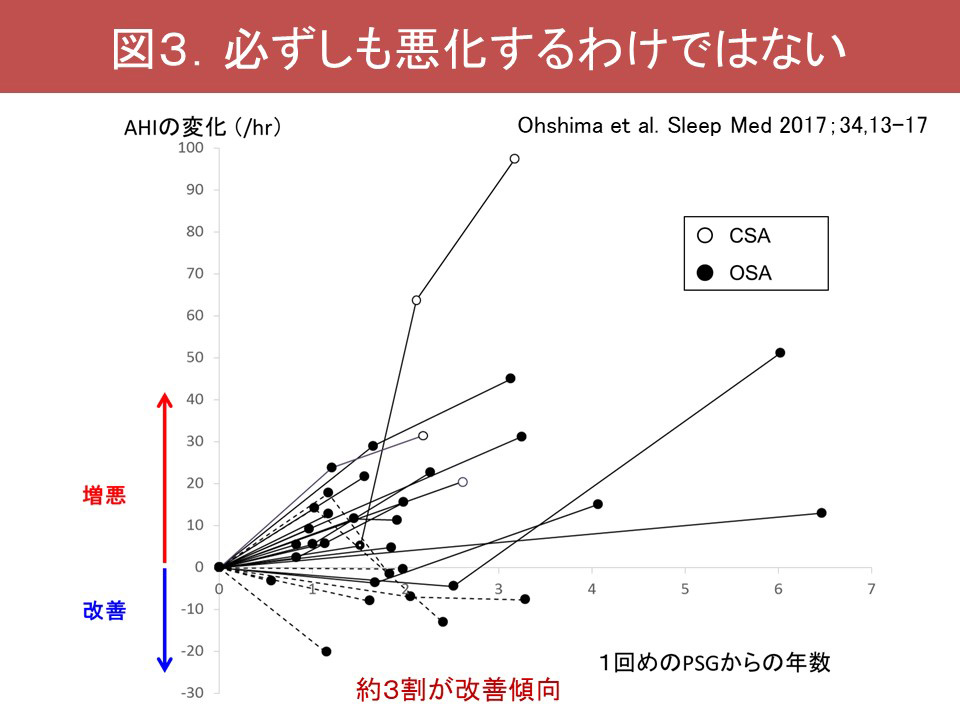
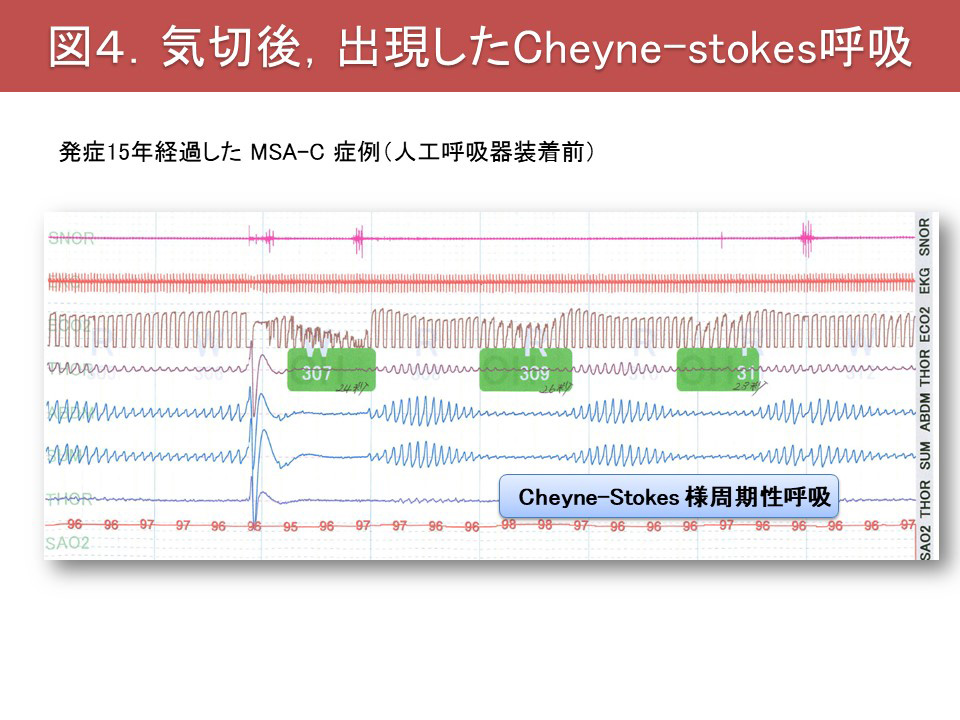
またMSAでは睡眠関連呼吸障害(sleep-related breathing disorders;SRBD)も高頻度に認められ、しばしば重症です。MSAのSRBDは、①睡眠時無呼吸症候群(sleep apnea syndrome;SAS)、②中枢性呼吸障害に大別されます。MSAのSASでは、大きな低調の鼾に加え、声帯開大不全に伴う高調性の吸気性喉頭喘鳴が観察されます(図1)。さらに軟口蓋、舌根、喉頭蓋、披裂部といった多彩な部位で上気道閉塞が認められます(Shimohata, 2007)(図2)。喉頭蓋による閉塞はfloppy epiglottisと呼ばれ、喉頭蓋の支持の脆弱化により生じるものと推測されます。SRBDは必ずしも経時的に悪化するわけではなく、3割程度の症例で初回のポリソムノグラフィーでの所見より改善が認められます(Ohshima, 2017)(図3)。中枢性呼吸障害は進行期に合併することが多く、中枢性頻呼吸やCheye-Stoke様呼吸を呈します(図4)。
2. MSAのSRBDの治療
MSAに伴うSASに対し、非侵襲的陽圧換気療法(non-invasive positive pressure ventilation; NPPV)は有効です。一般に上気道の開存目的にはCPAP(continusous positive airway pressure ventilation)を、換気不全の合併を認める場合にはBPAP(bi-level positive airway pressure ventilation)を選択します。CPAP機には無呼吸アラームの装備がないため、BPAP機をCPAPモードで使用することが呼吸停止を発見するのに役に立ちます。またアラームの音量にも注意が必要で、就眠している家族が気がつく音量に設定することが大切です。NPPVに加え、気管切開術も生存期間を延長させますが、中枢性呼吸障害等のため突然死を完全に防止することはできません。
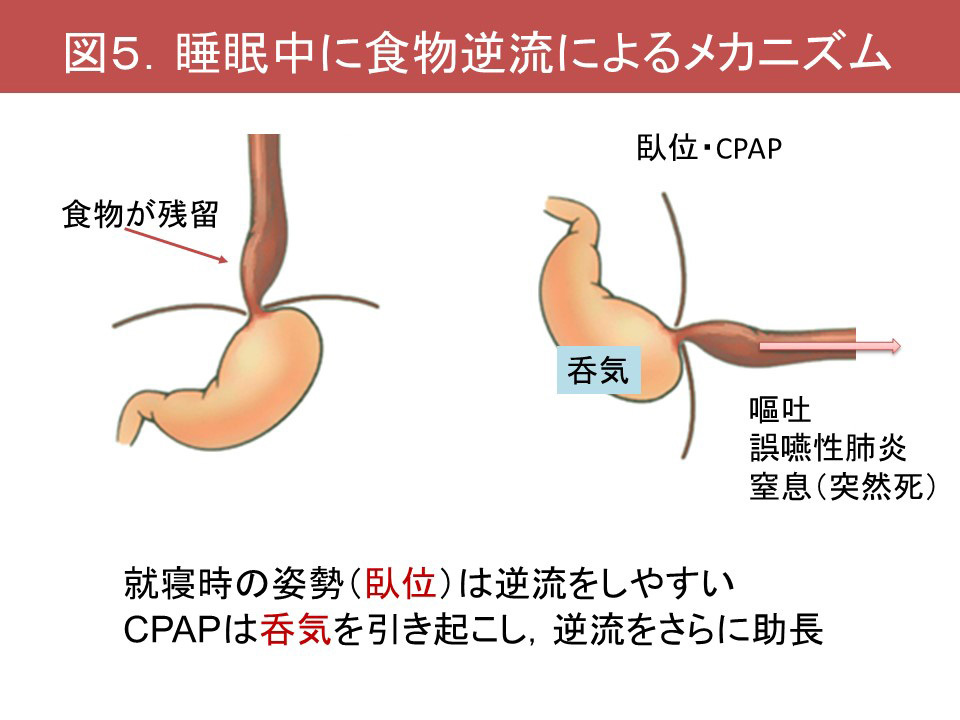
MSAにおけるNPPVの注意点として、第1に食道の蠕動低下に伴う、食道内の食物貯留が挙げられます。食物が食道に貯留した状態で就寝すると。就寝時の姿勢(臥位)やNPPVに伴う呑気のため食物の逆流が生じ、嘔吐ののち、誤嚥性肺炎や窒息による突然死が生じる可能性があります(Taniguchi, 2015)(図5)。対策として、食べてすぐ就寝しないこと、顔全体を覆うマスクインターフェイスを避けること(吐瀉物による窒息が生じるため)、重症例ではNPPVを中止することを検討します。第2にNPPV 治療が上気道閉塞の増悪を引き起こすことがあります。Floppy epiglottisを認める場合に注意が必要で、NPPVによる陽圧が喉頭蓋を上気道奥への押し込み、窒息をもたらす可能性があり、基本的にfloppy epiglottisに対してNPPVは禁忌と考えられます(Shimohata, 2011)。NPPV前にプロポフォール鎮静下喉頭内視鏡検査で確認ができれば理想的ですが、困難な施設がほとんどの状況です。少なくともNPPVの導入後の夜間酸素飽和度モニター(PulSox®など)を数日間、確認することが不可欠です。NPPVは低圧から開始し、徐々に圧を上げること、酸素飽和度が増悪した場合や呼吸苦が出現した場合には導入を中止することが重要です。
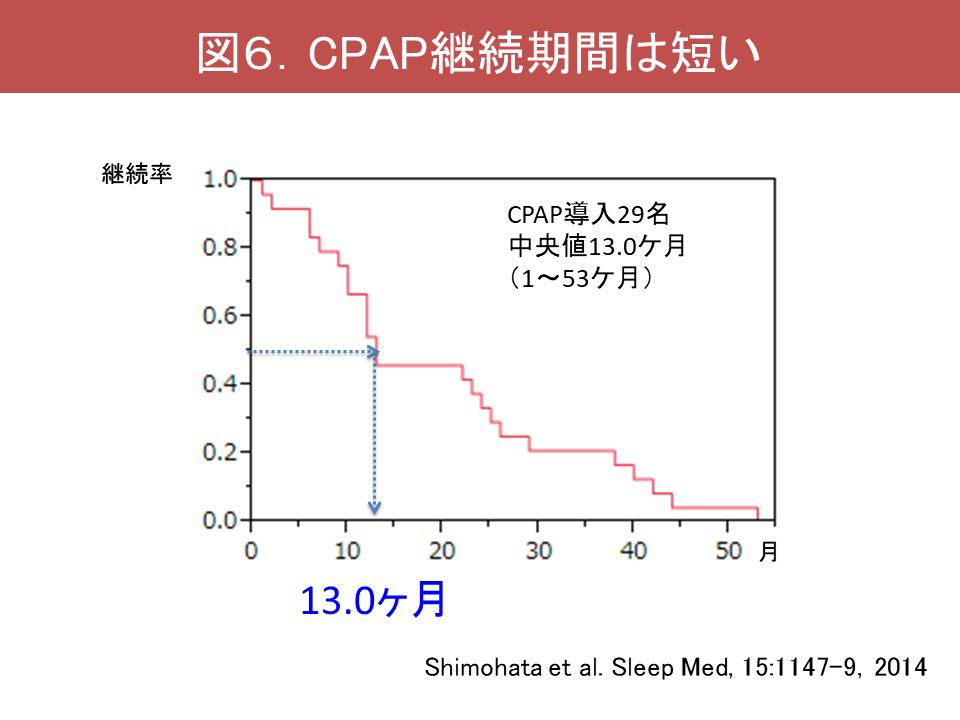
またCPAPの継続期間は13.0ケ月と、長期間の継続は困難です(Shimohata, 2014)(図6)。中止の原因としては、誤嚥の反復・排痰困難、日中の呼吸不全の合併、floppy epiglottisの合併、頻尿による装着困難があります。このため、CPAPの中止後には気管切開術や気管切開下陽圧換気療法を行うか否かの選択が必要になります。しかし気管切開術のみでは中枢性呼吸障害による突然死は防ぐことはできません。人工呼吸器装着を行うと長期生存が可能となりますが、疾患の進行に伴い大脳の萎縮を呈し、認知症状態となる症例があります。このため治療選択のジレンマが生じ、自己決定やその支援は非常に難しいものと言えます。
3. 臨床倫理的問題
MSAの診療においては、さまざまな臨床倫理的問題があります。
①いつどのように突然死のリスクを告知するか?②告知後、死の恐怖にいかに寄り添うか?③治療の自己決定をいかに支えるか?は重要な問題です。
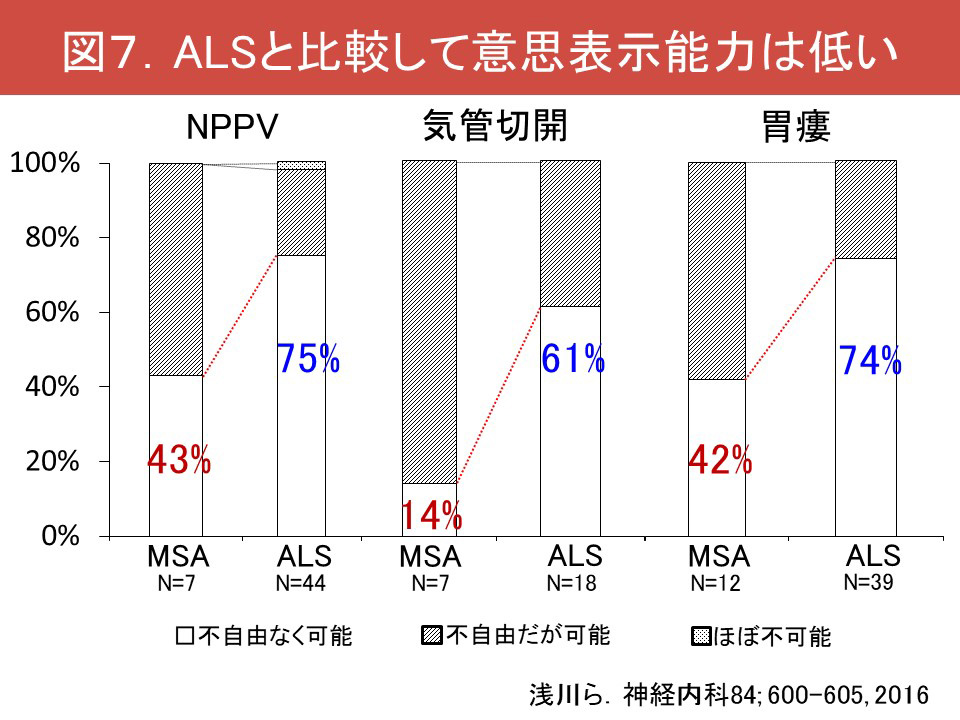
以下は私見ですが、患者さんの「知る権利」の尊重のため、基本的に突然死のリスクを伝える必要があるものの、症例ごとに熟考する必要があると思います。具体的には病前・発病後の性格、認知症や精神疾患の合併の有無、さらにbad newsをどれだけ知りたがっているか、告知のタイミングとして主治医との信頼関係はできたか、突然死のリスクは差し迫っているかを考慮する必要があります。突然死のリスクがさほど高くないMSAの診断時のような発症早期から、画一的に突然死のリスクをお伝えするのは、いたずらに患者さん、ご家族の心理的ストレスを増強すると思います。ただし突然死のリスクを正確に評価する指標はまだなく、今後の検討が必要な状況です。現時点では経験的に、睡眠関連呼吸障害が重症である症例、Cheyne-Stokes様呼吸や中枢性頻呼吸、中枢性無呼吸のような中枢性呼吸障害が目立つ症例、自律神経症状が早期から顕著である症例などでは十分な注意が必要と考えます。またMSAでは治療介入時の意思表示能力がALSと比較しても顕著に不良であることを認識し(図)、コミュニケーション障害の対策を立てつつ、告知のタイミングを逃さず、アドバンス・ケア・プラニングを行っていくことが大切です。
最後に、MSAにおいては、治療の意思決定、尊厳死・安楽死、人工呼吸器の装着・取り外し、告知、事前指示といった問題がこれまでほとんど議論されていないため、今後、これらの臨床倫理的問題に対する議論を盛り上げて、どのような告知や告知後の支援が望ましいのか、コンセンサスを形成する必要があることを強調したいと思います。
文献
Shimohata T, Shinoda H, Nakayama H, et al. Daytime hypoxemia, sleep-disordered breathing, and laryngopharyngeal findings in multiple system atrophy. Arch Neurol 64:856-861, 2007.
Ohshima Y, Nakayama H, Matsuyama N, et al. Natural course and potential prognostic factors for sleep-disordered breathing in multiple system atrophy. Sleep Med 34:13-17, 2017.
Taniguchi H, Nakayama H, Hori K, et al. Esophageal Involvement in Multiple System Atrophy. Dysphagia 30:669-673, 2015.
Shimohata T, Tomita M, Nakayama H, et al. Floppy epiglottis as a contraindication of CPAP in patients with multiple system atrophy. Neurology 76:1841-1842, 2011.
Shimohata T, Nakayama H, Aizawa N, et al. Discontinuation of continuous positive airway pressure treatment in multiple system atrophy. Sleep Med 15:1147-1149, 2014.