分光光度計を使ったタンパク質定量法の測定原理と実際
主なタンパク質定量法には、紫外吸収法、Bradford法(クーマシーブルー法)、Lowry法(フェノール試薬法)、ビシンコニン酸法(BCA法)などがある。それぞれに、長所、短所があり、また同じサンプルでも定量法によって、結果に大きな差が見られることがある。したがって、それぞれの特徴を知り、自分の実験にあった方法を選択し、一連の実験では同じ測定法を使用することが望ましい。
A)タンパク質定量法の原理
1)紫外吸収法
[原理]波長280 nm におけるタンパク質中の芳香族アミノ酸(チロシン、トリプトファン)の吸光度を測定する。(芳香族のベンゼン環に由来する紫外吸収)
| (長所) | 操作が簡便である。 |
| サンプルの回収が可能である。(他の方法にない利点) | |
| (短所) | タンパク質により吸光係数(チロシン、トリプトファンの含量)の差が大きい。 |
| 核酸など、他に吸収を持つ物質があると不正確になる。 | |
| 感度が低い。 | |
| (定量範囲) | 100-1000 μg/ml |
<測定法の概略>
紫外部が測定可能な分光光度計を用いて、タンパク質サンプル溶液の波長280 nmでの吸光度を測定する。タンパク質濃度はA280=1.0=1 mg/mlとして計算する。A280/A260 <1.5 の時は核酸の混入が考えられるので、他の方法を検討した方がよい。
2)Bradford法
[原理]タンパク質の染色に用いられる色素クーマシーブルーが、タンパク質と結合する際の吸光度の変化を測定する。
| (長所) | 操作が簡単で、妨害物質が少ない。 |
| (短所) | タンパク質により発色率に差がある。 |
| 界面活性剤の混入により測定値が不正確になる。 | |
| (定量範囲) | 50-1000 μg/ml(5倍希釈液使用時)、5-25 μg/ml(原液使用時) |
<測定法の概略>
タンパク質サンプル溶液とクーマシーブルー試薬をよく混和し、タンパク質を含まないバックグラウンドとの波長595 nm<における吸光度の差を分光光度計で測定する。タンパク質濃度が明らかな標準サンプル(スタンダード)の吸光度から描いた標準直線から、タンパク質濃度を求める。
3)Lowry法
[原理]フェノール試薬とタンパク質(チロシン、トリプトファン、システインが関与)とが結合する際の吸光度の変化を測定する。
| (長所) | 感度が高い。 |
| (短所) | 妨害物質が多い。 |
| 蛋白質によって発色率に差がある。 | |
| 時間がかかる。 | |
| (定量範囲) | 50-100 μg/ml |
<測定法の概略>
タンパク質サンプル溶液にアルカリ性銅溶液を加え、その後フェノール試薬をよく混和して、バックグラウンドとの波長750 nmにおける吸光度の差を分光光度計で測定する。タンパク質濃度が明らかなスタンダードの吸光度から描いた標準直線から、タンパク質濃度を求める。
4)BCA法
[原理]ビシンコニン酸と銅の錯体がタンパク質と結合する際の吸光度の変化を測定する。
| (長所) | 操作が簡単で、感度が高い。 |
| 界面活性剤の影響をあまり受けない。 | |
| (短所) | チオール、リン脂質、硫酸アンモニウムなどにより阻害を受ける。 |
| (定量範囲) | 20-1000 μg/ml |
<測定法の概略>
タンパク質サンプル溶液とビシンコニン酸試薬をよく混和して、バックグラウンドとの波長562 nmにおける吸光度の差を分光光度計で測定する。タンパク質濃度が明らかなスタンダードの吸光度から描いた標準直線から、タンパク質濃度を求める。
測定法を理解するための基礎知識
1)吸光度とは?
強度 I0 の単波長の光が物質層を通過して強度 I となったとき、A=log10(I0/I) をその波長のおける物質層の吸光度と呼ぶ。また、T= 100 X I/I0を透過パーセントと呼び、AとTとの対応は、T=100%, A= 0;T=50%, A= 0.30;T=10%, A=1.00;T=1%, A=2.00 となる。
2)定量的比色測定法<Lambert-Beerの法則>
ここに挙げた測定法では、サンプルの吸光度の変化によりタンパク質濃度の測定が可能である。これはどうしてであろうか?
厚さdの溶媒層および溶液層を通過した光の強さをそれぞれI a およびI 、溶液の濃度をc、比例定数をκとすると、次式の関係が成り立つ。
|
|
|
この式は、吸光度が物質中の光路の長さに比例するというLambertの法則と、溶液の濃度に比例するというBeerの法則から導かれる。すなわち、吸光度はその光路の長さと濃度の両方に比例する。これをLambert-Beerの法則と呼ぶ。溶液の濃度が比較的薄く溶質分子同士の相互作用がないときにはこの法則が成立する。また、κは物質が1モル当たりどれだけの光を吸収するかを表す定数であり、分子吸光係数と呼ばれる。
したがって、一定の大きさのキュベットを用いて吸光度を測定し、溶媒層(バックグラウンド)では吸光度が0になるように設定すれば、次式の関係が成立し、溶液の濃度cと吸光度Aとの間には比例関係が成立する。
|
|
|
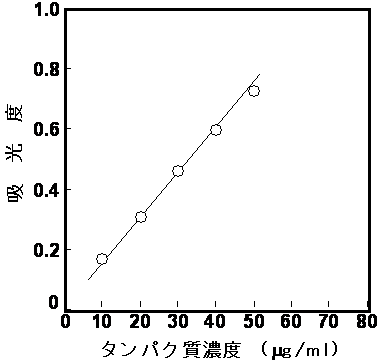
3)標準直線(検量線)の作成
(2)から(4)の測定法では、タンパク質濃度を測定したいサンプルとともに、タンパク質濃度が明らかな標準サンプル(スタンダード)(定量可能範囲内で異なる濃度のものを4、5本作成するのが一般的)を実験法にしたがって処理し、それぞれのスタンダードの濃度と吸光度の関係を示すグラフを作成する。タンパク質濃度とそれぞれの試薬による発色には比例関係があるので、Lambert-Beerの法則が成立する濃度範囲では、吸光度とサンプルのタンパク質濃度との間に比例関係が成立する。したがって、作成したグラフからそれぞれのサンプルのタンパク質濃度を求めることができる。ただし、サンプルの吸光度が著しく大きい(通常1以上)場合はLambert-Beerの法則が成立しないため、サンプルを希釈して測定し直す必要がある。
また、反応条件(溶液中の内容物、温度、反応時間など)が測定毎に少しずつ異なる可能性があるので、測定毎にスタンダードを用いて標準直線を作成し、サンプルのタンパク質濃度を決定することが望ましい。
実際のグラフの作成には、グラフ用紙が便利。また、コンピューターでグラフを作成し、比例関係を数式化してサンプルの濃度を計算で求めることも可能である。
スタンダードタンパク質濃度と吸光度との比例関係の一例
B)タンパク質定量の実際
今回の実習では、1日目(木曜日)に以下の基礎編の実験を行い、タンパク質定量法の測定原理を理解し、実験法を習得する。2日目(金曜日)には、応用編の実験を行い、理解を深める。
1)基礎編
<実験1> 紫外吸収法によるタンパク質の定量
(準備)
(測定)
ここでは、異なる濃度のウシ血清アルブミン (BSA)溶液(0 μg/ml、100 μg/ml、200 μg/ml、500 μg/ml、1000 μg/ml)および異なる濃度のウシミルク中のカゼイン溶液(0 μg/ml、100μg/ml、200 μg/ml、500 μg/ml、1000 μg/ml)の吸光度を測定し、それぞれの濃度と吸光度の関係を示すグラフを作成し、タンパク質の違いによりグラフがどのように変化するか、またA280=1.0=1 mg/mlが妥当であるかどうかを考察する。
<実験2> Bradford法によるタンパク質の定量
(準備)
(測定)
<実験3> BCA法によるタンパク質の定量
(準備)
(測定)
2)応用編
<実験4> 培養細胞からのタンパク質の抽出と定量
実際の研究では、臓器断片や培養細胞などからタンパク質を抽出し、解析する。臓器片からはホモジナイザーや超音波破砕機により組織を破壊し、目的とする細胞小器官を得ることも可能である。しかし、膜画分に含まれるタンパク質は界面活性剤などを用いない限り可溶化(溶媒に溶かす)が困難な場合が多い。ここでは、培養細胞のタンパク質を、界面活性剤を含むタンパク質抽出液で抽出し、タンパク質濃度を測定する。
(準備)
|
(測定)
(注意)
昨日の実験でスタンダードを用いて標準直線を作成したが、反応条件(溶液中の内容物、温度、反応時間など)が測定毎に少しずつ異なる可能性があるので、測定毎にスタンダードを用いて標準直線を作成することが望ましい。
<参考資料>
[紫外部分光光度計の使用法]
[分光光度計の使用法](詳しくは測定室の壁に貼ってある操作法を参照)
[マイクロプレートリーダーを用いた測定]
量の少ないサンプル、あるいは多数のサンプルを同時に処理する場合、マイクロプレートのウエル中(総液量500 μl以下)で反応を行い、そのままマイクロプレートの各ウエルの吸光度をマイクロプレートリーダーを使用して測定することもある。一般に使用されるマイクロプレートには96個の穴(ウエル)があり、マイクロプレートリーダーにより96サンプルまでの吸光度を短時間に自動的に測定できる。これを使用すると、定量試薬および測定時間を節約することができる。また、マイクロプレートリーダーの機種によっては、バックグラウンドとスタンダードのウエルの位置と、スタンダードの濃度を指定しておけば、各サンプルのタンパク質濃度を自動的に計算してくれるスグレモノもある。